内吞体/溶酶体内的酸性蛋白酶对蛋白降解、维持细胞功能具有重要意义。在溶酶体病理性严重损伤或破裂时,大量溶酶体酸性蛋白酶被释放至胞浆,可导致细胞自溶和凋亡。因此,内吞体/溶酶体囊泡被称为细胞体内的“自杀炸弹”。
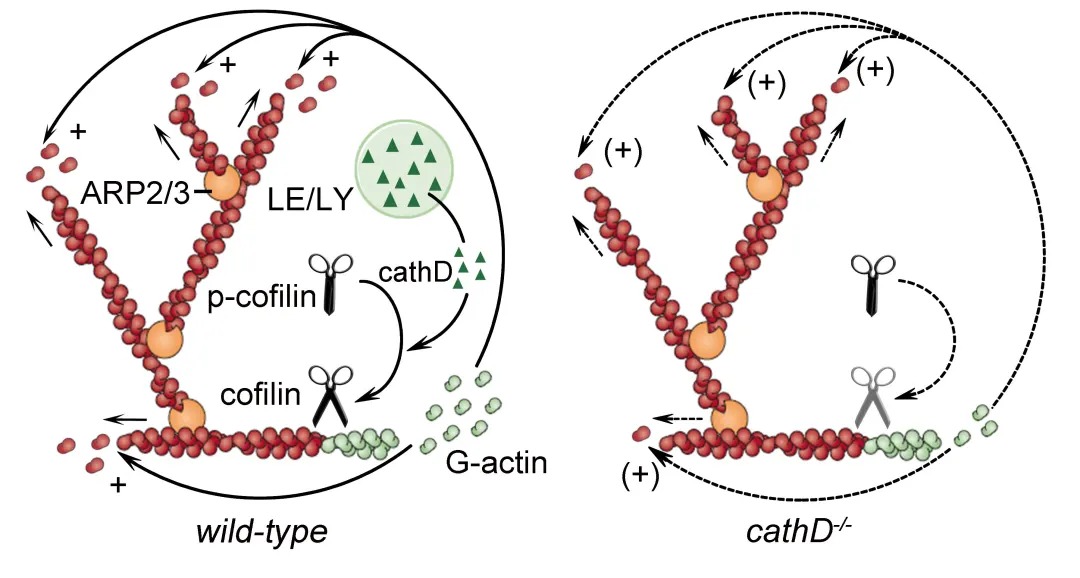
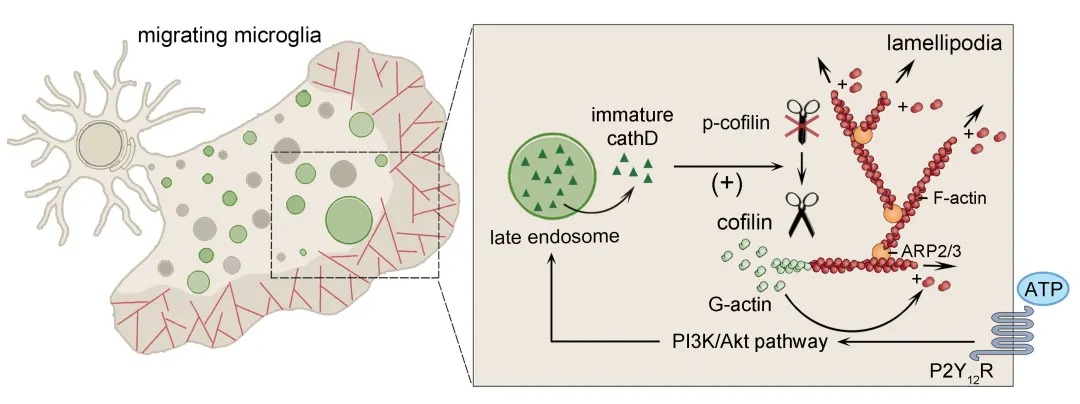
然而,近年研究表明,溶酶体蛋白酶同样存在于胞浆等非囊泡环境中。但大多酸性蛋白酶在脱离酸性环境后很快失去蛋白水解能力,并不足以导致细胞死亡。溶酶体蛋白酶在非囊泡环境中行使的功能尚不清楚。 近日,浙江大学医学院脑科学与脑医学院段树民院士团队研究发现,大脑损伤时,病灶释放的ATP信号激活小胶质细胞P2Y12受体及其下游PI3K/Akt信号通路,诱发内吞体/溶酶体囊泡膜通透性升高。同时,原本定位于内吞体/溶酶体的酸性蛋白水解酶cathepsin D出现于迁移细胞的伪足前沿,而该部位并没有内吞体/溶酶体囊泡的其它成分,提示cathepsin D在小胶质细胞迁移过程中可能脱离内吞体/溶酶体囊泡。 通过进一步检测,研究人员发现,这些伪足定位的cathepsin D尚未成熟,主要来自晚期内吞体,最终被转运至胞浆。敲除cathepsin D或抑制其向胞浆转运,将严重干扰小胶质细胞伪足的持续铺展,导致小胶质细胞在响应损伤信号后的迁移发生阻滞。为揭示cathepsin D如何调节小胶质细胞伪足运动,研究人员通过免疫共沉淀结合质谱分析,寻找cathepsin D在胞浆中的结合蛋白。经鉴定发现,cathepsin D结合并调节丝切蛋白cofilin,促使cofilin活化并剪切微丝骨架,为微丝骨架快速重组过程及时提供充足的骨架“原材料”单体肌动蛋白(G-actin)。 该研究首次发现内吞体-溶酶体囊泡具有调节微丝细胞骨架动态组装的功能。其中,晚期内吞体在小胶质细胞迁移过程中,发挥微丝骨架“拆迁加速器”的作用,通过向胞浆释放未成熟cathepsin D调控cofilin介导的微丝骨架重组,维持小胶质细胞定向迁移。 该论文于2020年12月9日在线发表于 Science Advances 浙江大学医学院脑科学与脑医学学院段树民院士为本文主要通讯作者,浙江大学医学院脑科学与脑医学学院王晓东研究员、上海科技大学何淑君研究员和段树民院士团队讲师刘怿君为本文共同通讯作者。刘怿君为第一作者。该研究得到上海科技大学罗振革教授、清华大学俞立教授、复旦大学蔡亮教授的支持和帮助,受到科技部重点研发计划、国家基金委等项目资助。